f #note
Configuration electronique
Les orbitales peuvent être trouver sous des formes exactes pour l’atome d’hydrogene, parametriser par les nombre quantiques , , . Ont ne peut malheureusement pas trouver de solution exacte pour les orbitales d’atomes plus compliquer.
Cependant, il est possible de combiner les orbitales de l’hydrogene pour trouver les configurations electroniques d’atomes plus compliquer. Ont nomme l’ensemble de toutes le orbitales d’un atome la configuration electronique.
Il est relativement facile de trouver ces configuration electroniques. Il existe cependant plusieur méthode.
La regle qui gouverne tout dans ce cas est le fait que l’ont remplis les orbitales en ordre énergétique
L’ordre des orbitales est : 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p
Our le premier nombre indique le nombre quantique principal, et la letre indique la forme de l’orbitale selon son nombre . Ont nomme cette notation spdf
En notation spdf
Prenont par example, le bore. Le bore a 5 electrons, ont vas comencer par remplir la premiere orbitale , dans laquel ont peut mêtre deux electrons. Ont a donc
Il nous reste 3 electrons. Ensuite, ont remplis l’orbitale , ont a donc :
Il nous reste 1 electron, que l’ont vas mêtre dans la prochiane orbitale, soit , ont a donc :
Ce qui est la configuration electronique du bore
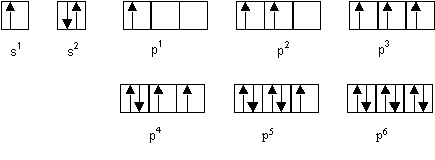
Modele de cases quantique
Le modele de case quantique est une autre représentation de la configuration electronique d’un atome.
Ont représente chaque orbitale par une case, ou ont désine une flêche vers le haut si il y a un electron, et ont rajouter une flêche vers le bas dans le cas de deux electrons, pour indique le spin.
Fig. 1 : Cases quantique
Deux case coller les unes sur les autres ont la même énergie.
Regle de hund
Quand l’ont remplis plusieur cases quantique avec le même niveau d’énergie, ont doit d’abord placer toutes les electrrons avec un spin, puis tout les electrons avec l’autre spin. Ont peut voir cela dans les cases pour l’orbitale dans la Fig. 1
Exeptions
Comme toute bonne regle, il y a des exeption.
Certaines orbitales sont tres proche énergétiquement les unes des autres. C’est le cas des orbitales et .
Dans le chome, il manque uniquement un electron pour remplir l’orbitale . Un electron vas donc être “voler” a l’orbitale pour remplir celle ci. La configuration electronique sera donc :
A la place de :
Cette eception s’aplique également de maniere similaire pour le molybdene, le cuivre et l’argent, car ils sont tous a un electron de remplir leur derniere orbitale
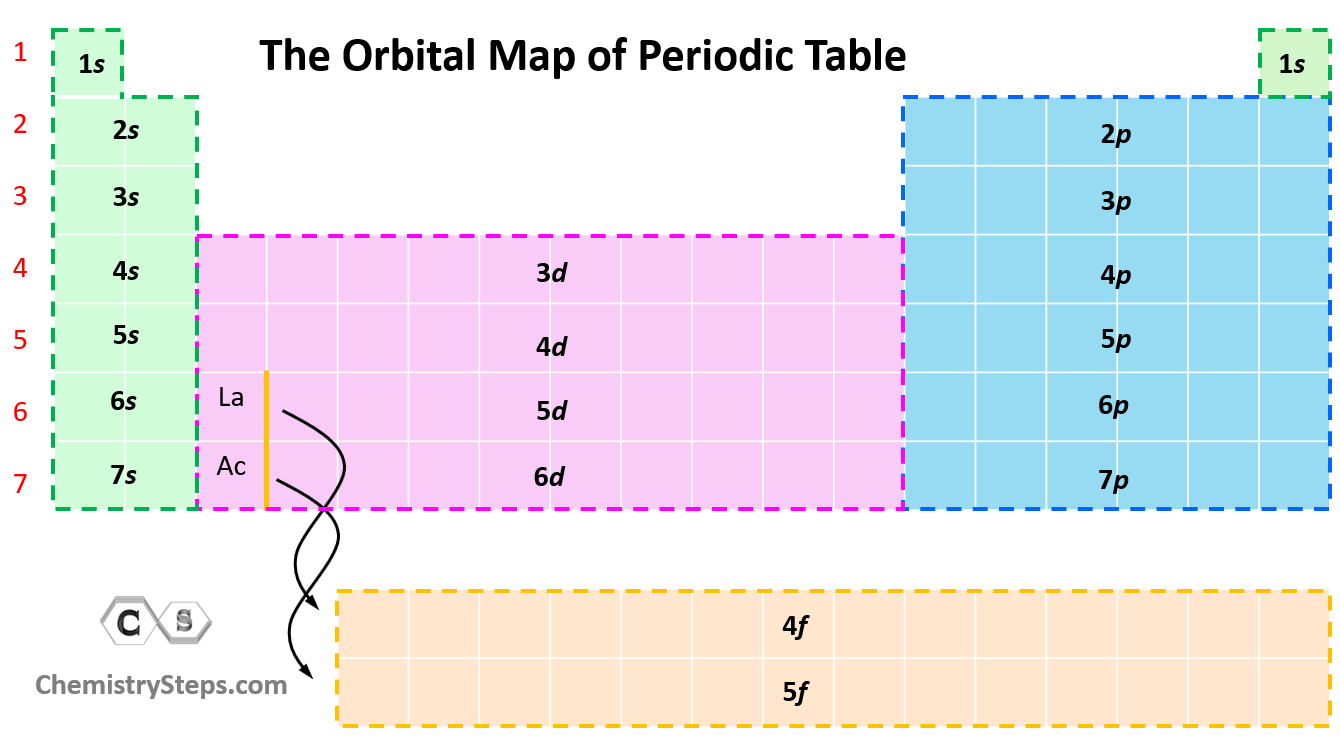
Racourcis par le tableau periodique
Ont peut rapidement trouver la configuration electronique d’une atome en regardent les bloques dans le tableau periodique.
Fig. 1 : Les blocs d'orbitales dans le tableau periodique
Ont fait simplement lire le tableau periodique de gauche a droite, haut en bas, et l’ont note les configuration electroniques que l’ont rencontre.
Attention
Il faut encore appliquer l’exeption pour le chrome, le molybdene, le cuivre et l’argent