Forces de dispersion (london)
Ont nomme forces de dispersion ou force de london les interaction atractive entre deux molecules neutre.
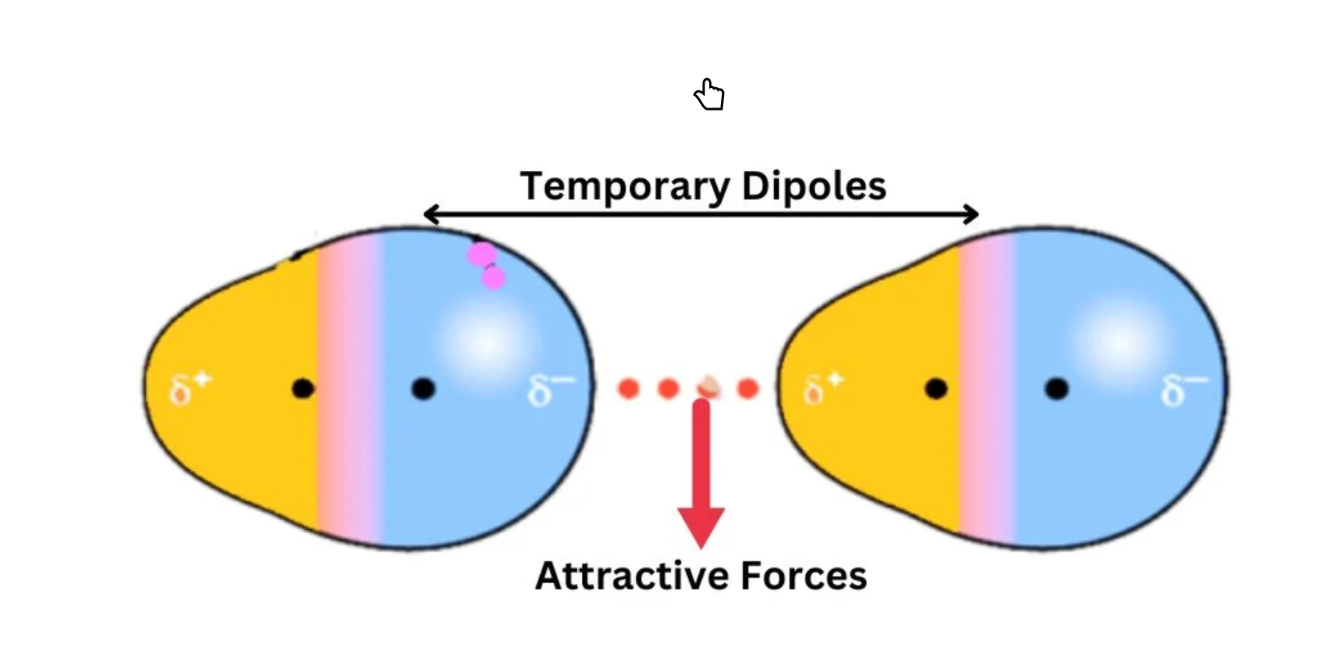
Cette interaction est due au fait que, en raison de flucutation dans la position des electrons, les electrons dans une molecule peuvent momentanément être débalancer, créant une polariter. Ont nomme ceci un dipole instantaner.
Ce dipole instanter vas induire une dipole dans l’autre molecule, et ceux si vont ensuite s’atirer.
Fig. 1 : Ilustration des dipole instaner
Ont nomme la capaciter d’une molecule a être polariser par une autre dipole la polarisabiliter. Plus une molecule est polarisable, plus un dipole vas pouvoir lui induire un dipole.
Cette forces agist a des distance tres courte, et est faible.
Ont peut la prédire par les regle du pouce suivante :
- Plus la surface des deux molecule est grande, plus il y a des forces de london
- Peut être aproximer par la masse molaire
- Plus les molecule sont polarisable, plus il y a de forces intermoleculaire
- Une grande molecule est génoralement plus polarisable. C’est également aproximable par la masse molaire
- Plus la surface de contact est grande, plus la force est grande.