f #note
Cour 16
Résonance
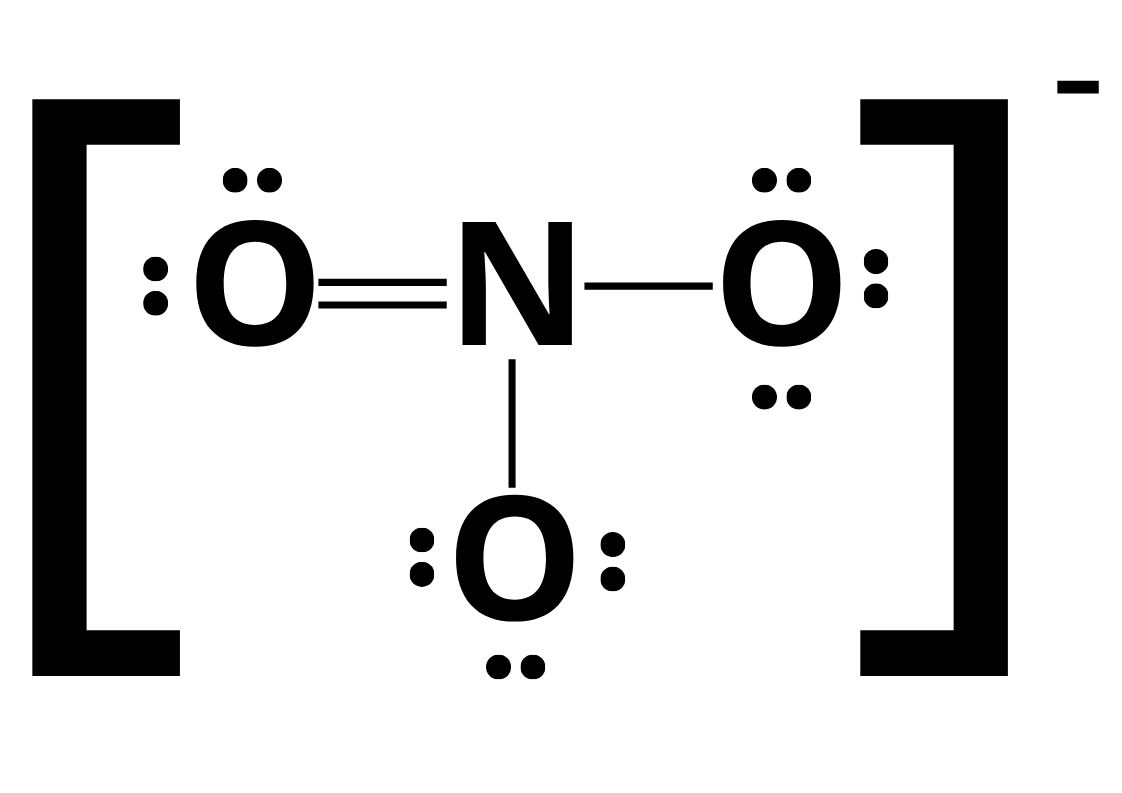
Pour certaines molecules les structures le lewis ne représente pas la réaliter. Un example les l’ion nitrate ()
Fig. 1 : Strucutre de lewis de l'ion nitrate
Entre les liason doubles simple et triples, la plus longue est la liason simple.
Cependant, si ont observe l’ion nitrate experimentalement, ont remarque qu’il n’y a pas de liason simple ni double. L’énergie des liasons est plus basse que le lcalcul le prédit.
Par example, dans l’ion nitrate, il y a plusieur possibiliter pour les emplacements des charges et du lien double. Ont peut imagine que la moyenne de tout les liens sont partiels, car ils peuvent tous être une liason double.
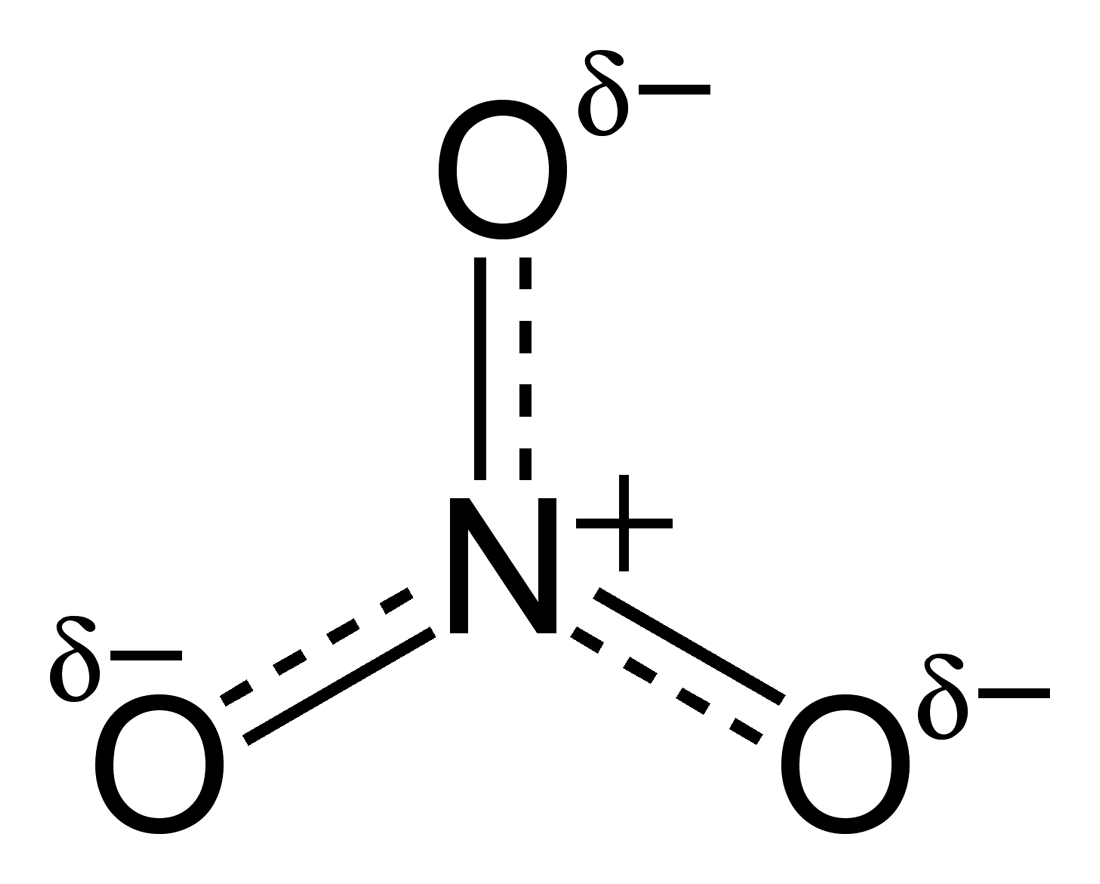
Fig. 2 : La vraie structure
Ont peut voire icic des leisn pointiler qui dénote le fait qu’ils ne sont pas des liason simple, ni des liason doubles. Ont nomme ses structure des formes limites de résonance.
Ce qui représente mieux la réaliter c’est la moyenne de toutes les structures de lewis possible.
Par example, dans l’ion nitrate. Ont a 4 liason possible pour l’atome d’oxygene au total (une double et deux simple). Ont a trois packet d’électron, ont a 4/3 de liason. Ont représente ceci par une ligne pleine et une ligne pontiller.
Pour les doublet libres, il y en a 8 doublet au total possible au total, et trois posibiliter ou les mettres, donc 8/3 de doublet par atome.
Pour ce qui est des charges, ont a trois posibliter pour l’atome (-1, -1, 0), et trois posibiliter, donc ont vas avoir une charge moyenne de -2/3
Ont nomme cette molecule l’hybride de résonance.
Pour savoir si il y a de la résonance,