f #note
énergies d’ionisation
Attention
Ceci s’aplique uniquement pour les blocs s et p du tableau periodique
Premiere énergie d’ionisation
La premiere énergie d’ionisation est l’énergie d’ionisation requise pour passer un atome d’un étas neutre a un étas .
La premiere énergie d’ionisation est une propriété periodique qui dépend de la charge nucléaire effective.
Généralement, plus la charge nucléaire effective est grande, plus il est dificile d’ioniser, et odnc plus la premiere énergie d’ionisation est grande.
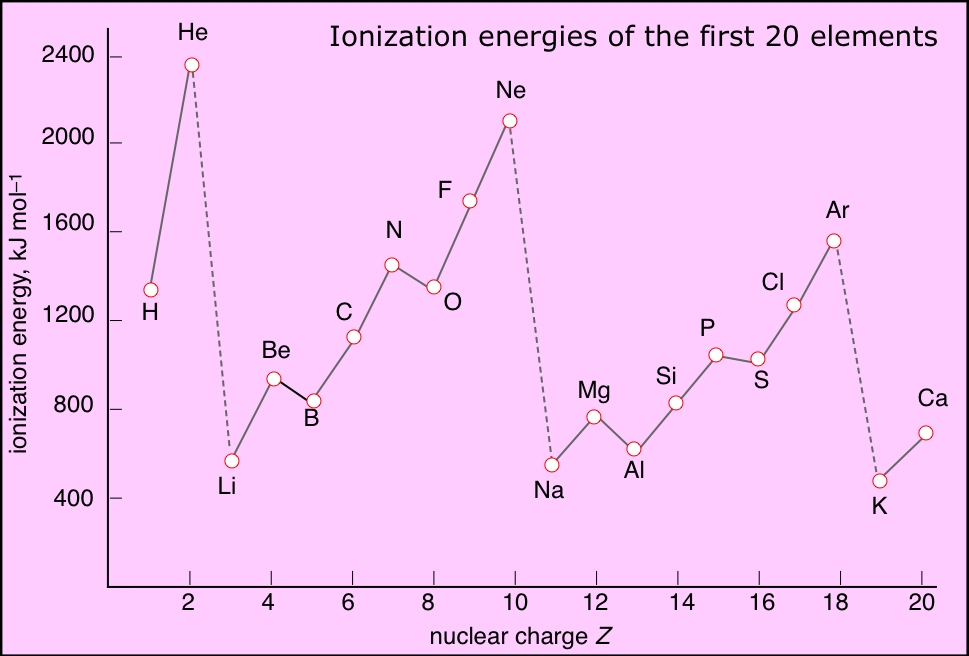
Fig. 1 : Graphique des premiere énergie d'ionisation en fonction de l'atome
Exeptions
Toute bonne regle a des exeptions, voici celles qui s’apliquent ici. Le Bore et l’oxygene ont des valeurs abnormalent base. Cela est causer par le fait qu’il est plus facile de retirer un atome de l’orbitale s que de l’orbitale p, ce que la tendence ne tient pas en compte. Cela est due au fait de la symetrie spherique d’une couche electronique sois complêtement replis d’un seul spin, ou complêtement replis.
Énergies d’ionisations
Il y a plusieur énergie d’ionisation, qui déterminine l’énergie pour retirer un electron de plus a un atome. Par example, la deuxieme énergie d’ionisation détermine combien d’énergie est requise pour passer d’un étas a un étas , et ansi de suite pour la troisieme, ect.
Ils suivent généralement la tendence suivante pour un même atome :
Un example d’une telle serie serait, par example :
| EI | kj/mlol |
|---|---|
| 1 | 200 |
| 2 | 400 |
| 3 | 700 |
| 4 | 4000 |
| 5 | 4900 |
Ont peut voir qu’il y a une grande augmentation entre et . Cela est causer par le fait que l’ont passe a une orbitale avec une énergie differente. C’est a dire que l’ont arête de retirer les electrons de valence et ont comence a retirer les electrons de coeur.
Attention
Ont peut uniquement comparer les énergie d’ionisation pour un même atome