f #note
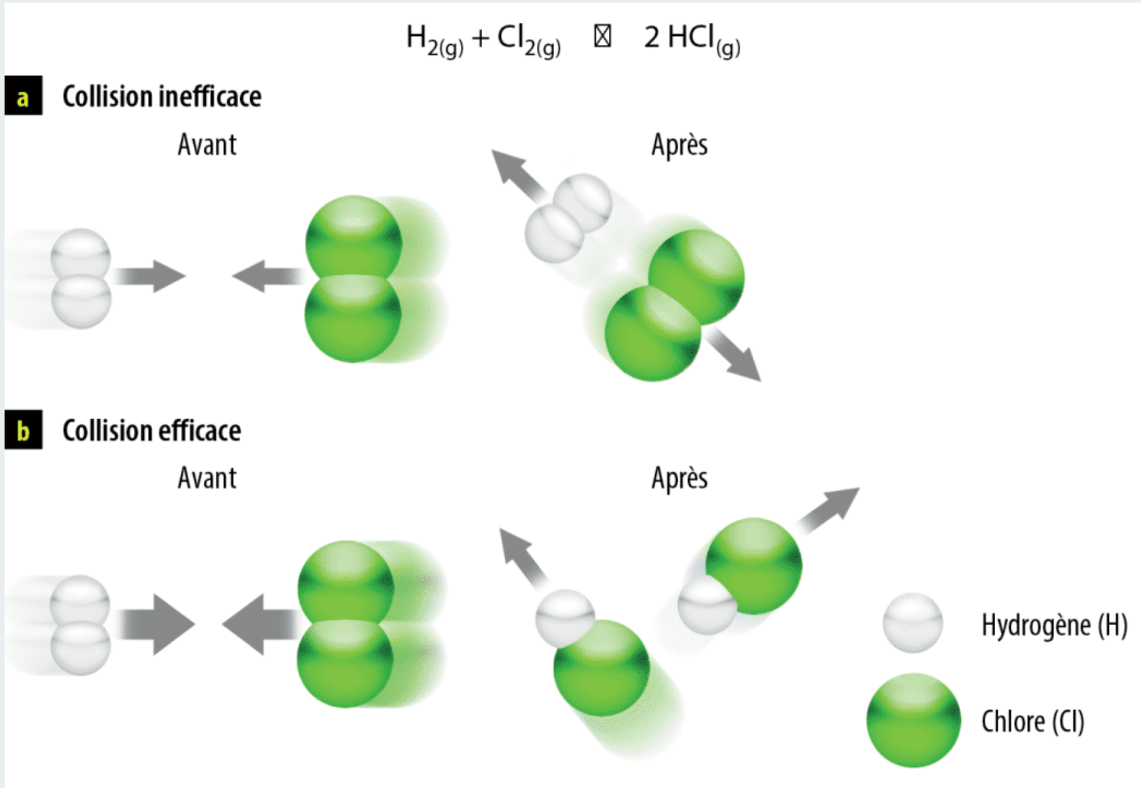
Les collisions efficases
Ce ne sont pas toutes les collision entre deux réactifs qui mpeme a des réaction chimique. Souvent, une colision n’a pas asser d’énergie d’activation pour se rendre au complexe activer, et bien ont obtien une colision inéfficaces (ou collision élastique).
- Collision eficase : L’énergie d’activation est sufisante, la reaction chimique prend place
- Réaction inefficaces ou collision élsatiques : L’énergie d’activation est unsifsante et il n’y a pas de réaction.
Pour qu'une colision soit éfficce, une colision doit avoir :
- La bonne quantiter d’énergie
- La colision arrive selon l’angle approprier
Plus une réaction a de collision efficase, plus la vitesse de réaction est élever
Fig. 1 : Differents type de colision
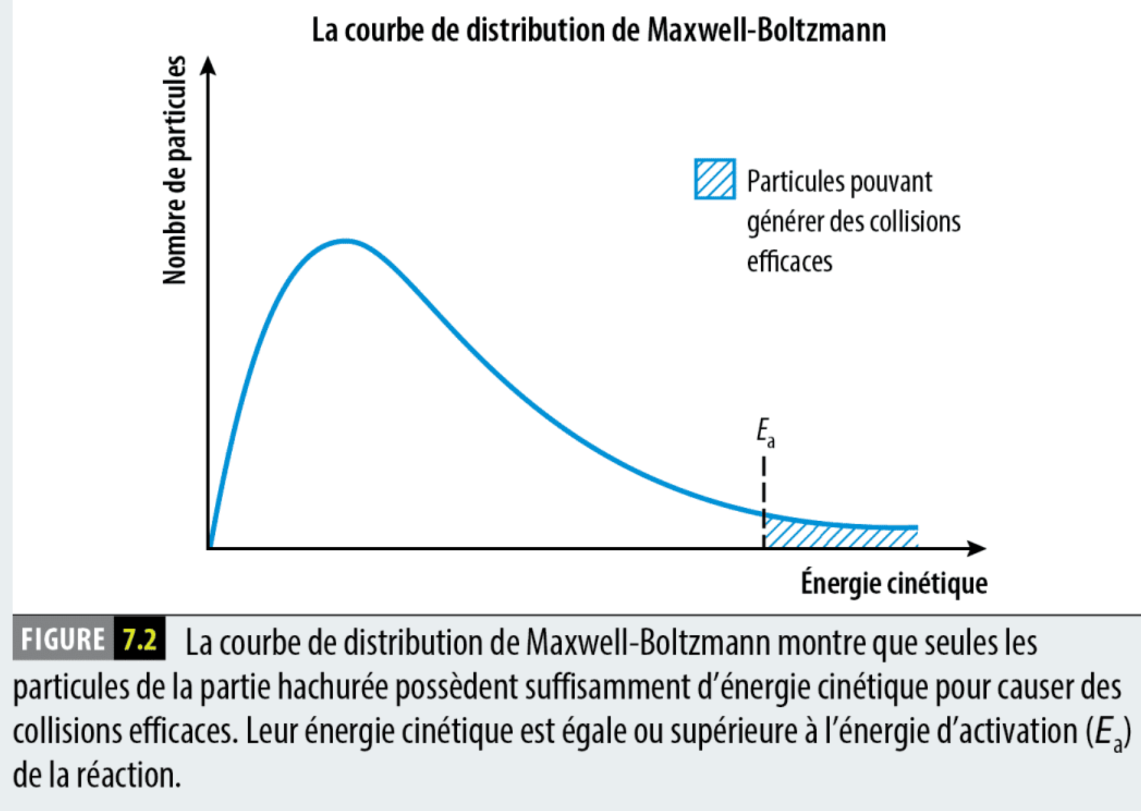
La courbe de dstribution maxwell-boltzman
La courbe de maxwell boltman decrit le nombre de particule qui ont une certaine énergie, ont peut donc voire combine de particulle ont asser d’énergie our faire des collision efficaes.
Résumeé de l’influence des différens facteurs sur la vitesse de réaction
- Nature des réactifs
- Moins il y a de lisaison, plus la vitesse est rapide ou grande.
- Plus il y a des liasons fortes, plus la vitesse est lente ou pettite
- La phase des réactifs
- La comparaison doit être faire a la même température. Pour évalue la vitesse, pon procède dans l’ordre suitant :
- Si les réactiofs présents sont dans plusieur phases, la vitesse serat plus lente
- Généralement, s’ils sont dans la même phase, la vitesse de la réaction seras plus rapideé
- La comparaison doit être faire a la même température. Pour évalue la vitesse, pon procède dans l’ordre suitant :
Attention
Plusieur solides ensemble seront plus lent que des liqudes, ce qui seront plus lent que des gazeux, ce qui seras plus rapideque des aqueux.