f #note
Les facteurs qui influence l’état d’équilibre
Effet de la variation de la concentration des réactifs sur l’équilibre
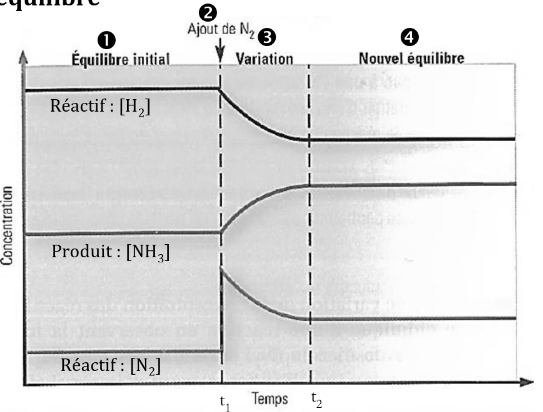
Fig. 1 Changement de concentration
Ont peut voire dans la fig.1 que si ont a un systeme a l’état d’équilibre, et on provoque une perturbation en augmentant la concentration de . Ont peut donc voire que la réaction prend ensuite un certain temp a reprnde un nouvel equilibre.
Entre et le principe de le chatelier s’appliquer pour contrer la perturbation. Ont peut vaire que plsu de réactifs se transforment en produit pour contrer la perturbation. Conséquament, la réaction directe a été favoriser (la synthèse de l’amoniac dans notre cas.)
Si ont ajouter ou retire un réactif a l'état liquide ou solide, sa concentration ne change pas. L'équilibre synamique ne change donc psa non plus.
Attention
Il faut toujour écrire “mais reste sup. a la cons. initial” quant ont augmente la concentration d’un réactifs ou d’un produit et que la concentration de celui si rediminue.
Tablea d’équilibres
Pour dénoter l’équilibre, il faut le faire dans un tableau tel celui ci :
| 1 : Équilibre intialle | Perturbation | Principe de chatelier | Représenation sous forme de diagrame |
|---|---|---|---|
| Il faut également faire une etite balencer pencher | Il faut écrire quelle sens de la réaction serat favoriser, puis écrire que c’est pour inverser la perturbation |
Effet de la temperature
Pour reguarder la perturbation de l’équilibre avec la température, il faut avoir un équiation thermochimique.
Quant ont augmente la temperature, c’est le côter qui a l’énergie qui est favoriser et donc c’est dans ce sens que c’est desabiliser.
Le princique de chatelier agiras donc sur le côter qui a l’énergie, pour diminuer l’énergie.
L’équiation thermochique dans la colone de l’équilibre intitial doit être écrite avec l’énergie incluse, le côter de l’énergie depend du signe.
Effet d’un catalyseur
Un catalyseur n’a pas d’effet sur l’état d’équilibre pare qu’ils modifie la vitesse de la reaction inverse et directe également. Le rajout d’un catalyseur durant l’ateinte de l’équilbire ne fait qu’ateindre le même équilibre plus rapidement.
Effet de la pression
L’effet de la pression sur un systeme est liée aux gaz.
Attention
La pression est inversement proportionelle au volume, donc si il y a une augmentation dans le volume, la pression baise.
Si ont variue uniquement le volume, il y a nécésairement une variation dans le volume.
Si la perturbation consite a augmenter la pression, la réaction favoriser est celle qui faborise celle formant le moin de molécule gazeuse. Le but est donc de diminuer le nombre de mole de gaz pour diminuer la pression.
Si la perturbation consite a diminier la pression, la réaction favoriser est celle formant le plus de molécules en phase gazeuse.
Pour faire une perturbation de pression, il faut que :
- Le systeme comporte au moins une susbtrance gazeuse
- La quantiter () de susbtance n’est pas égale du côter des réacts et des produits
- Il faut que le milieux de réaction soit incompressible.
Notation
Pour représenter une perturbation de volume, si par example, ont diminue le volume :
Équilibre init Perturbation Chatelier Représentation
VSfav. inverse
---
pour etet
Attention
Si le nombre de mole est égale des deux côter, il n’y a pas de principe de le chatelier, mais il faut quant même noter que les concentration non pas changer, si demander.